دوره های آموزشی
- توضیحات
- نوشته شده توسط مدیریت سایت
- دسته: حرارت مركزي و بخار
- تاریخ ایجاد در 07 بهمن 1388
- بازدید: 552

- توضیحات
- نوشته شده توسط مدیریت سایت
- دسته: حرارت مركزي و بخار
- تاریخ ایجاد در 01 بهمن 1388
- بازدید: 896
اكچوايتور ها :
اكچوايتورهاي نئوماتيكي :
- توضیحات
- نوشته شده توسط مدیریت سایت
- دسته: حرارت مركزي و بخار
- تاریخ ایجاد در 30 دی 1388
- بازدید: 1004
آب به صورت برگشت پذیر ولی به مقدار خیلی کم یونیزه می شود. تجزیه آب به صورت آنقدر کم است که در دمای اتاق در هر لیتر آب مقطر فقط 7-10مول +H با همین مقدار -OH در حال تعادل است. یعنی یک مولکول از هر 555000000 ( 108 × 55/5 ) مولکول آب به +H و -OH تجزیه می شود ولیکن بسیاری از ویژگی آب از همین مقدار کم یونیزاسیون ناشی می شود.
حاصلضرب یونی آب KW چنین تعریف می شود.
مقدار Kw بستگی به دما دارد که در شکل زیر نشان داده شده است. رابطه فوق همواره صادق است و به ناخالصی های آب بستگی ندارد. قدرت اسید هر محیط آبی توسط PH بیان می شود که چنین تعریف می شود:
امروزه به سهولت با دستگاه pH متر امکان پذیر است. اما نباید فراموش کرد که هیچ آنالیزی بدون معلون کردن pH کامل نخواهد بود و نیز توجه داشته باشید که pH به دما بستگی دارد.
» قلیاییت آب
قلیایت آب نمایانگر ظرفیت آب برای خنثی کردن اسید افزوده شده و تا رسیدن به pH حدود 5/4 است. هرچه قلیاییت آب بیشتر باشد ظرفیت بافری آن بیشتر است. بنابراین دانستن قلیاییت آب مکمل دانستن pH آب می باشد، چون pH آب معرف قدرت اسیدی آب بوده ولی قلیاییت آب معرف مقاومت آب در برابر تغییرات pH است. آبی که حاوی 1ppm گاز Co2 و 10ppm قلیاییت باشد دارای همان PH آبی است که حاوی 10ppm گاز Co2 و 100ppm قلیاییت است. اما اگر به آب اولی 4ppm از گاز Co2 اضافه کنیم PH آن کاملا تغییر می کند ولی اگر به آب دومی همان مقدار گاز CO2 اضافه کنیم، تغییر PH آن قابل توجه نیست و این معرف نقش قلیاییت در تولید محیط بافری در آب می باشد. قلیاییت آب طبیعی معمولا برابر مجموع غلظت یون های بی کربنات، کربنات و هیدروکسیل است. غلظت آنیون های دیگر چون فسفات یا سیلیکات در مقایسه با غلظت این سه یون قابل صرفنظر کردن هستند. در تصفیه آب نه فقط دانستن مجموع غلظت آنیون های تشکیل دهنده قلیاییت مهم است بلکه دانستن غلظت هر یک از آنیون ها هم مهم است. از این رو با اندازه گیری دو نوع قلیاییت، غلظت هر یک از سه آنیون تشکیل دهنده قلیاییت مشخص می شود.دو نوع قلیاییت عبارتند از:
1-قلیاییت ساده یا قلیاییت نسبت به فنل فنالئن P
2 – قلیاییت کل یا قلیاییت نسبت به متیل اورانژ M
روش اندازه گیری قلیاییت
محلول های لازم برای آزمایش: 1- محلول02/0 N سولفوریک اسید. 2- معرف فنل فتالئین و متیل اورانژ
برای اندازه گیری قلیاییت، 100cc از نمونه مورد نظر را در یک ارلن مایر 500cc و 3 تا 4 قطره معرف فنل فتالئین بدان اضافه کنید. در صورتی که محلول ارغوانی شود، قلیاییت دارد و در غیر این صورت قلیاییت ندارد. اگر محلول ارغوانی شود پس از ریختن به اندازه کافی سولفوریک اسید، رنگ ارغوانی از بین خواهد رفت که PH محلول در این شرایط 8/3 خواهد شد.
هر سانتیمتر مکعب از سولفوریک اسید مصرف شده معرف 10ppm قلیاییت ساده و بر حسب ( معادل کربنات کلسیم ) است. واکنش های انجام شده تا این مرحله به صورت زیر است.
اگر بخواهیم قلیاییت کل را پیدا کنیم باید در حضور معرف متیل اورانژ به تیتراسیون ادامه دهیم تا رنگ زرد پرتقالی (پوست پیازی) ظاهر شود PH در این نقطه حدود 5/4 می باشد. کل اسید مصرف شده از ابتدا تا PH حدود 5/4 را در 10 ضرب کرده تا قلیاییت کل پیدا شود. در محدوده قلیاییت کل ( که شامل محدوده قلیاییت ساده هم می شود ) واکنش های زیر انجام می شود.
جدول زیر می تواند به درک بهتر مفهوم دو نوع قلیاییت کمک کند.
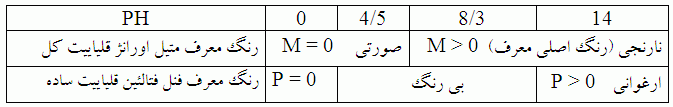
توجه کنید که در تصفیه آب PH برابر 7 به مفهوم PH سرنوشت ساز مطرح نیست. در واقع PH حدود 5/4 در تصفیه آب نقش مهمتری از PH برابر 7 دارد چون معرف عدم وجود قلیاییت در آب است. می توان از فرمول زیر برای محاسبه قلیاییت آب استفاده کرد.
که در آن V حجم اسید مصرف شده با نرمالیته N است و Wحجم آب نمونه است.
» یادآوری این نکته مهم است که PH مطلوب آب دیگ بخار 11 الی 11.8 می باشد.
صنایع مهندسی برق و بخار
- توضیحات
- نوشته شده توسط مدیریت سایت
- دسته: حرارت مركزي و بخار
- تاریخ ایجاد در 29 دی 1388
- بازدید: 331
مقدار مجاز آهن و منگنز بسیار کم و برای آبهای صنعتی حدود Mg/L 0/3 – 0/005 و برای آبهای آشامیدنی به ترتیب Mg/L 0/3 و Mg/L 0/05 می باشد.
آهن و منگنز به صورت دو ظرفیتی محلول بوده و اغلب در آبهای زیرزمینی دیده می شوند. اگر به صورت بی کربنات محلول باشند، می توانند در اثر اکسید شدن و در نتیجه ته نشین شدن تولید لکه ها و بعضا خطوط رنگی نمایند.
این دو، نقش خوراک را برای بعضی از میکروارگانیسم ها دارند و در نتیجه رشد آنها را تشدید می کنند. معمولا آبهای پشت سدها که در عمق کم قرار دارند به علت مجاورت با اتمسفر و وجود اکسیژن محلول می توانند عاری از آهن و منگنز باشند، ولی آبهای در عمق زیاد، به علت فعالیت باکتریها و فقدان اکسیژن، حاوی آهن و منگنز هستند. اگر آب آشامیدنی حاوی آهن باشد، مزه آن نامطبوع خواهد شد.
در محیط باقلیاییت و سولفاید کم، حلالیت آهن و منگنز از روابط زیر تبعیت می کند:
اما در عمل بخاطر تشکیل یون های کمپلکس، حلالیت این دو فلز بیشتر از آنچه که در روابط بالا گفته شده، می باشد. حداقل حلالیت این دو فلز در PH حدود 12 می باشد و در PH های حدود 7، آب قادر است که مقدار زیادی از این دو فلز را به صورت محلول داشته باشد.
در آبهای طبیعی به علت وجود قلیاییت، در محدوده PH برابر 5/6 تا 5/9، حلالیت این دو فلز توسط حلالیت نمک کربناتهای آنها کنترل می شود یعنی:
رنگ لکه های حاصل از رسوب آهن از زرد تا قهوه ای متمایل به قرمز متغیر است و رنگ لکه های منگنز سیاه متمایل به ارغوانی می باشد.
آهن و منگنز می توانند رزین های تعویض یونی را آلوده کرده و با تولید ذرات رسوب کارشان را مختل سازند. منگنز همیشه با آهن دیده نمی شود و معمولا مقدار آهن بیشتر است. منگنز پر دردسر تر از آهن و حذف آن هم مشکل تر می باشد.
به لحاظ اینکه یون فرو ( آهن دو ظرفیتی ) عامل تشخیص مهمی برای خورندگی می باشد، و تشخیص آن از یون فریک اهمیت بسیاری دارد. معرف شیمیایی ( ارتوفنانترولین ) در صورت وجود یون فرو، رنگ قرمز به آب می دهد.
چون روش حذف این دو یون یکسان است بنابراین با هم مورد بحث قرار می گیرند. سه روش مهم برای حذف این دو عبارتند از:
الف - اکسیداسیون به همراه ته نشینی و فیلتراسیون
ب – فیلتراسیون با زئولیت منگنز
ج – استفاده از رزین های تعویض یونی
صنایع مهندسی برق و بخار
- توضیحات
- نوشته شده توسط مدیریت سایت
- دسته: حرارت مركزي و بخار
- تاریخ ایجاد در 28 دی 1388
- بازدید: 511
هر گاه مواد آلی به صورت غیر برگشت پذیر به رزین چسبیده باشند می توان گفت که رزین آلوده به مواد آلی شده است روش هایی برای تمیز کردن رزین های صنعتی پیشنهاد شده است که دو روش آن در زیر توضیح می دهیم:
الف – روش تمیز کردن با آب نمک قلیایی: بعضی از مواد آلی در زمان احیا کردن رزین آنیونی با سود سوز آور از رزین حذف نمی شوند. در این حالت می توان از محلول آب نمک قلیایی برای تمیز کردن رزین استفاده کرد. به علت تمایل زیاد یون کلر به نمک طعام، سدیم کلراید یکی از موثرترین نمک ها می باشد. گروه کربوکسیل از ماده عاری چسبیده به نقطه فعال رزین، راحت تر و کامل تر از یون هیدروکسیل جدا می شود. البته لازم به ذکر است که حضور هیدروکسی سدیم در محلول نمک، راندمان تمیز کردن را بهبود می بخشد. غلظت آب نمک قلیایی باید تقریبا 10% نمک طعام ونسبت به سود سوز آور 2% باشد و بهتر است تا دمای ˚C 40 هم گرم شده باشد.
نمک سدیم کلراید علاوه بر غالب شدن بر جاذبه یون کربوکسیلات و رزین می تواند در PH بالا (محیط قلیایی) جذب سطحی غالب مولکول های آلی را کاهش و حلالیت آنها را افزایش دهد.
ب – تمیز کردن با آب ژابل (هیپوکلریت سدیم): در بعضی از موارد آلودگی با مواد آلی، بویژه در مواقعی که تمیز کردن با آب نمک قلیایی برای مدت طولانی صورت نگرفته یا منظم نبوده و یا آلودگی آن چنان شدید است که تمیز کردن با آب نمک چاره ساز نیست، می توان برای تمیز کردن انواع رزین های آنیونی از هیپوکلریت سدیم استفاده کرد.
آب ژابل یا هیپوکلریت سدیک (که پیشنهاد می شود حاوی 1 درصد کلر آزاد باشد) اکسید کننده قوی و خطرناک است و بنابراین احتیاط را نباید از دست داد. عوامل اکسید کننده قوی می توانند باعث شکستن شبکه رزین شوند.
برای انواع خاصی از اتصالات یا هنگامیکه اتصالات ضعیف باشند نمی توان به طور مکرر از هیپوکلریت سدیم استفاده کرد، زیرا منجر به صدمه دیدن رزین می شود. به طور کلی این روش فقط در صورتی که روش های کم خطر دیگر موفق نبودند باید استفاده شوند.
اگر بستر رزین مختلط باشد باید قسمت کاتیونی کاملا اشباع باشد، چون محلول های اسیدی می توانند از هیپوکلریت سدیم، گاز کلر آزاد کنند. زمان پیشنهاد شده برای تماس بین رزیون وحلول حدود 4 ساعت است.
»» نگهداری و انبار کردن رزین ها مهم است. رزین ها معمولا به صورت مرطوب در ظرف هایی که آب ونور به داخل آن نفوذ نمی کند، نگهداری می شوند. اگر ظرف حاوی رزین به علت استفاده از قسمتی از رزین باز شده باید دقت کرد که مجددا بسته شود.
برای انبار کردن طولانی رزین باید آن را به صورت اشباع نگه داشت و در موقع استفاده آن را احیا کرد. دانه های رزین ممکن است در اثر یخ زدن صدمه ببیند هر چند که ممکن است این ضایعات قابل مشاهده نباشند اما تاثیر آن در موقع استفاده و زمان سرویس دیده می شود. دمای بیش از ˚C 40 باعث خشک شدن رزین و کاهش راندمان آن می شود.
SOURCE: d'A lelio, G,F., U.s. patent No. 2,366, 007.
صنایع مهندسی برق و بخار
جدید ترین اخبار
- بیخبری اصناف از پروژه سرویس رایگان کولرها
- اگر سیستم تهویه مطبوع متفاوتی اختراع کنید ۳ میلیون دلار جایزه خواهید گرفت
- نیاز ۱.۷ میلیون لیتر نفت سفید برای سیستم گرمایشی مدارس لرستان
- تریلر حامل 219 دستگاه چیلر جذبی قاچاق به ارزش 10 میلیارد ریال در شهرستان ارسنجان توقیف شد.
- سرعت رشد انرژی های نو برای عبور از بحران گرمایش زمین کافی نیست
- نمایشگاه تأسیسات سرمایش و گرمایش در شیراز
- گرمایش زمین گیاهان را قدبلندتر کرده است
- سهم اندک راهآهن در افزایش آلودگی هوا
- کاشت برنج مقصر دیگر گرمایش زمین می باشد
- کاهش تولید برق از از ظرفیت 12 هزار مگاواتی نیروگاه های برقابی به 7 هزار مگاوات
- تعویض یک میلیون کولر گازی غیر استاندارد
- تأثیر گرمایش زمین بر تکامل انسان
- خرید پکیج دیواری
- همراه جدید زغالسنگ در گرمایش زمین
- با 4 ایده فن آورانه در مصرف برق صرفه جویی کنید
- برنامه قطعی برق در منازل و مناطق مختلف کرمان به پایان رسید
- افزایش احتمال تب کریمه کنگو به دلیل فصل گرما/ ذبح دام در منازل غیربهداشتی است
- راه اندازي سيستم سرمايش ترمينال حجاج فرودگاه تبريز
- خود را برای پنج سال گرمتر از گرم آماده کنید!
- تهران همچنان بر مدار گرما
- چیلرهای جذبی قاچاق به مقصد نرسید
- مهندسان نقش اصلی در بهبود کیفیت ساختوساز دارند
- گرمایش زمین خطری برای زیرساختهای اینترنت در جهان
- بازدید فرماندار شهرستان آشتیان از تاسیسات آب و فاضلاب این شهر
- ۲۰ هزار مگاوات برق برای خنک شدن ایرانیان
- در گرمای زمین خواهیم سوخت
- کنفرانس بین المللی نقش مهندسی مکانیک در ساخت و ساز شهری
- حل معمای ۴۰ ساله: فضانوردان آپولو موجب گرمایش ناگهانی ماه شدهاند
- حضور اروپاییها در کنفرانس نقش مهندسی مکانیک در ساختوساز شهری
- ۲۰ هزار مگاوات برق برای خنک شدن ایرانیان
حاضرین در سایت
ما 24 مهمان و بدون عضو آنلاین داریم
جدیدترین مقالات
ورود به سایت
جدید ترین اخبار مرتبط
- بیخبری اصناف از پروژه سرویس رایگان کولرها
- اگر سیستم تهویه مطبوع متفاوتی اختراع کنید ۳ میلیون دلار جایزه خواهید گرفت
- نیاز ۱.۷ میلیون لیتر نفت سفید برای سیستم گرمایشی مدارس لرستان
- تریلر حامل 219 دستگاه چیلر جذبی قاچاق به ارزش 10 میلیارد ریال در شهرستان ارسنجان توقیف شد.
- سرعت رشد انرژی های نو برای عبور از بحران گرمایش زمین کافی نیست
- نمایشگاه تأسیسات سرمایش و گرمایش در شیراز
- گرمایش زمین گیاهان را قدبلندتر کرده است
- سهم اندک راهآهن در افزایش آلودگی هوا














